
|
| Les arômes |
 Les arômes se divisent en trois catégories : Les arômes se divisent en trois catégories :
- Les arômes naturels
Ils sont extraits de végétaux où ils existent à l'état naturel.
- Les arômes nature-identique
Ces arômes sont composés des mêmes molécules que les arômes naturels mais sont
obtenus par synthèse.
- Les arômes artificiels
Les molécules de ces arômes n'existent pas dans la nature, ils sont obtenus et
ont été découverts par synthèse chimique.
 Ces arômes sont de nature chimique variées, on peut citer : Ces arômes sont de nature chimique variées, on peut citer :
- les hydrocarbures, par exemple le citral et le limonène (citron)
- les alcools, par exemple le menthol (menthe).
-
les composés carbonylés (porteurs du groupement fonctionnel carbonyle
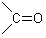 ), par exemple la vanilline (vanille). ), par exemple la vanilline (vanille).
-
les éthers (porteurs du groupement fonctionnel
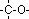 ), ils
sont peu nombreux, on peut citer pour exemple l'anéthole (anis). ), ils
sont peu nombreux, on peut citer pour exemple l'anéthole (anis).
- les esters, très simples à synthétiser, seront développés avec l'exemple de l'arôme banane
-
les hétérocycles, qui sont des molécules organiques cycliques et dont le cycle contient un atome différent
du carbone, sont les molécules aromatiques les plus nombreuses (25% de l'ensemble des composés aromatiques
connues actuellement). On peut citer le furanéol de la fraise.

Nous avons fabriqué de l'arôme banane et de l'huile essentielle d'orange.
 L'arôme banane L'arôme banane
 L'arôme artificiel de banane dont nous avons réalisé la synthèse est un ester, l'acétate d'isoamyle. L'arôme artificiel de banane dont nous avons réalisé la synthèse est un ester, l'acétate d'isoamyle.
Un ester est un composé formé par la réaction d'un acide carboxylique sur un alcool. Un alcool est un
composé chimique comportant le groupement fonctionnel -OH.
La réaction d'estérification est la suivante :
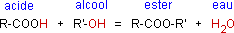
 Il s'agit d'une réaction réversible et non-totale, elle est très lente à température ambiante (plusieurs
jours). Pour l'accélerer, on ajoute un catalyseur comme l'acide sulfurique qui est un puissant
déshydratant (il capte l'eau qui se forme et empêche donc la réaction inverse d'hydrolyse de l'ester),
et on élève la température jusqu'à ébullition, ce qui permet de plus de réaliser une distillation. Il s'agit d'une réaction réversible et non-totale, elle est très lente à température ambiante (plusieurs
jours). Pour l'accélerer, on ajoute un catalyseur comme l'acide sulfurique qui est un puissant
déshydratant (il capte l'eau qui se forme et empêche donc la réaction inverse d'hydrolyse de l'ester),
et on élève la température jusqu'à ébullition, ce qui permet de plus de réaliser une distillation.
 Pour l'arôme banane, on a utilisé de l'acide acétique et de l'alcool isoamylique. L'ester formé est donc
l'acétate d'isoamyle.
Pour l'arôme banane, on a utilisé de l'acide acétique et de l'alcool isoamylique. L'ester formé est donc
l'acétate d'isoamyle.
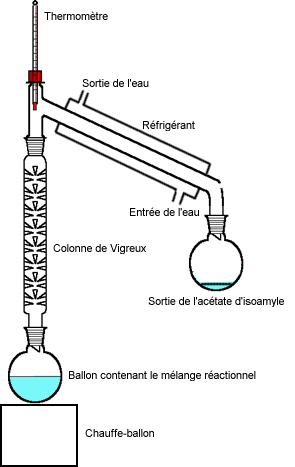
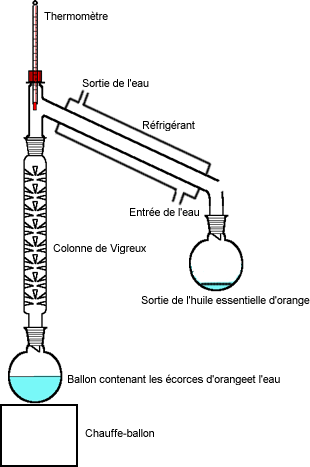
 Comme on le constate sur le dessin, la distillation se fait en utilisant une colonne de Vigreux.
Nous avons mis dans le ballon : Comme on le constate sur le dessin, la distillation se fait en utilisant une colonne de Vigreux.
Nous avons mis dans le ballon :
- 1 mL d'alcool isoamylique
- 3 mL d'acide acétique
- quelques gouttes d'acide sulfurique
- quelques grains de pierre ponce (qui favorise l'ébullition)
A la fin de l'expérience, nous avons obtenu quelques millilitres d'ester. On reconnaît facilement l'odeur
très forte rappelant la banane, cet arôme est utilisé dans les bonbons "arlequin" dont il a l'odeur.
 L'huile essentielle d'orange L'huile essentielle d'orange
 L'huile essentielle d'orange est un arôme naturel. L'huile essentielle d'orange est un arôme naturel.
Nous avons réussi à l'extraire d'écorces d'orange à l'aide
d'une distillation avec entraînement à la vapeur.
Nous avons lavé deux oranges afin d'éliminer les produits de traitement généralement pulvérisés sur les agrumes.
Ensuite, nous les avons épluchées en évitant de prendre la partie interne blanche de l'écorce. Nous avons
broyé ces peaux préalablement découpées en petits morceaux dans un mortier avec un peu d'eau. Puis ces morceaux
ont été placés dans un ballon et recouverts d'eau. Après avoir monté le système de distillation sur le ballon, nous
avons porté le mélange à ébullition.
 Le distillat, à forte odeur d'orange, se sépare en deux phases : l'huile essentielle, en quantité très faible au dessous
et l'eau aromatique en dessous. Pour séparer l'huile essentielle, nous avons versé ce distillat dans une ampoule
à décanter. Ensuite, nous avons rincé l'éprouvette graduée qui le contenait avec 20mL d'une solution saturée de chlorure de
sodium et nous avons versé également ce liquide dans l'ampoule à décanter. La présence d'ions Na+ et Cl-
diminue encore la solubilité, déjà très faible, des composés organiques dans l'eau. Lorsque les deux phases se
sont bien séparées, nous avons évacué toute la phase inférieure et recueilli l'huile essentielle dans un petit tube à essai
pour son analyse ultérieure par chromatographie. Le distillat, à forte odeur d'orange, se sépare en deux phases : l'huile essentielle, en quantité très faible au dessous
et l'eau aromatique en dessous. Pour séparer l'huile essentielle, nous avons versé ce distillat dans une ampoule
à décanter. Ensuite, nous avons rincé l'éprouvette graduée qui le contenait avec 20mL d'une solution saturée de chlorure de
sodium et nous avons versé également ce liquide dans l'ampoule à décanter. La présence d'ions Na+ et Cl-
diminue encore la solubilité, déjà très faible, des composés organiques dans l'eau. Lorsque les deux phases se
sont bien séparées, nous avons évacué toute la phase inférieure et recueilli l'huile essentielle dans un petit tube à essai
pour son analyse ultérieure par chromatographie.
 La technique de chromatographie est la même que pour les colorants alimentaires sauf que nous avons employé comme éluant
un mélange de dichlorométhane et de cyclohexane. De plus, les plaques nécessitent une révélation car les composés des
huiles essentielles sont incolores. Nous avons placé les plaques sous une lampe à UV et utilisé des réactifs permettant
de colorer les molécules organiques : la DNPH et le permangnate de potassium en solution. La technique de chromatographie est la même que pour les colorants alimentaires sauf que nous avons employé comme éluant
un mélange de dichlorométhane et de cyclohexane. De plus, les plaques nécessitent une révélation car les composés des
huiles essentielles sont incolores. Nous avons placé les plaques sous une lampe à UV et utilisé des réactifs permettant
de colorer les molécules organiques : la DNPH et le permangnate de potassium en solution.
En plus de l'huile essentielle que nous avons préparée, nous avons réalisé celles d'huiles essentielles de citron et
d'orange du commerce.
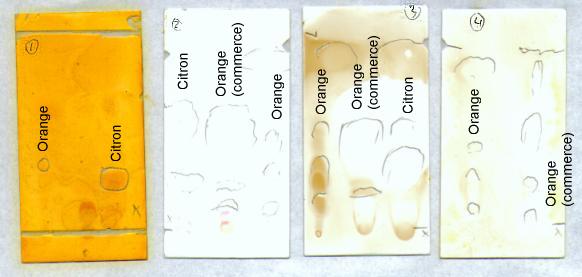
1 - Révélation à la 2,4-DNPH (dinitrophénylhydrazine)
2 - Révélation aux UV
3 - Révélation au permanganate de potassium
4 - Révélation au permanganate de potassium
On obtient les rapports frontaux suivants (moyennes) :
| Orange |
Orange (commerce) |
Citron (commerce) |
| 0,13 |
0,19 |
0,17 |
| 0,31 |
0,27 |
0,49 |
| 0,49 |
0,46 |
0,61 |
| 0,92 |
0,56 |
0,90 |
|
0,85 |
|
 Cela nous révèle que les huiles essentielles contiennent de très nombreux constituants.
Après recherches, nous savons que le limonène a un rapport frontal de 0,93 ; sa présence est
révélée dans les huiles essentielles d'orange et de citron du commerce (0,92 et 0,90). Cela nous révèle que les huiles essentielles contiennent de très nombreux constituants.
Après recherches, nous savons que le limonène a un rapport frontal de 0,93 ; sa présence est
révélée dans les huiles essentielles d'orange et de citron du commerce (0,92 et 0,90).
|
|
|